교통사고, 추락 등 외상으로 발생하는 척수손상은 환자에게 운동·감각기능 영구상실을 초래할 수 있다.
이는 뇌와 온몸을 잇는 신경의 중심통로인 척수에 손상의 회복을 멈춰 세우는 ‘교세포 장벽’ 때문이다.
교세포 장벽은 손상 직후 별세포와 다른 교세포들이 급격히 증식해 상처를 두껍게 둘러싸는 조직으로, 초기에는 손상 부위를 보호하지만 시간이 지나면서 신경이 다시 자라나는 길까지 막는다.
그러나 이에 대한 정확한 분자적 기전이 규명되지 않아 현재 척수손상 치료제는 주로 염증을 억제하거나 증상을 완화하는 데 그치고 있다.
척수손상 회복 막는 제동장치 찾았다
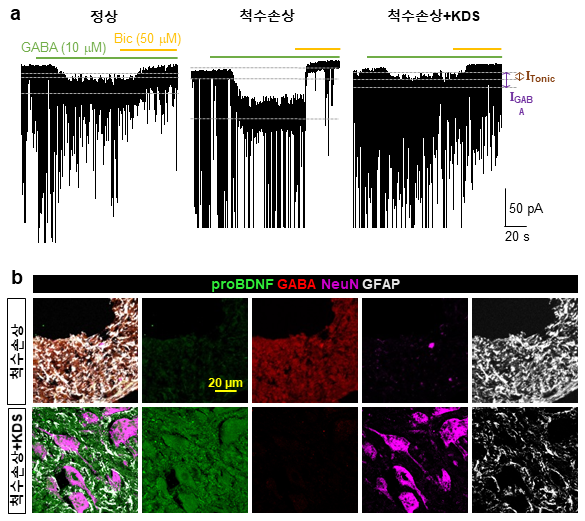
기초과학연구원(IBS) 이창준 인지및사회성연구단장팀이 연세대 의과대학 하윤 교수팀과 공동연구로 척수 내 별세포가 마오비(MAOB) 효소를 통해 생성하는 억제성 신경전달물질 ‘가바(GABA)’가 손상된 척수의 회복을 방해하는 핵심 원인임을 규명했다.
아울러 마오비 억제제의 회복효과를 입증해 약물을 통한 척수손상 치료 가능성을 제시했다.
이 단장 연구팀은 선행연구로 반응성 별세포가 마오비를 통해 가바를 비정상적으로 생성하고, 이것이 알츠하이머 등 퇴행성 뇌신경질환을 악화시킨다는 사실을 밝혔다.
별세포는 중추신경계의 항상성을 유지하지만, 질환이나 외상 등 병리적 자극을 받으면 수와 크기가 증가하고 기능이 변한다.
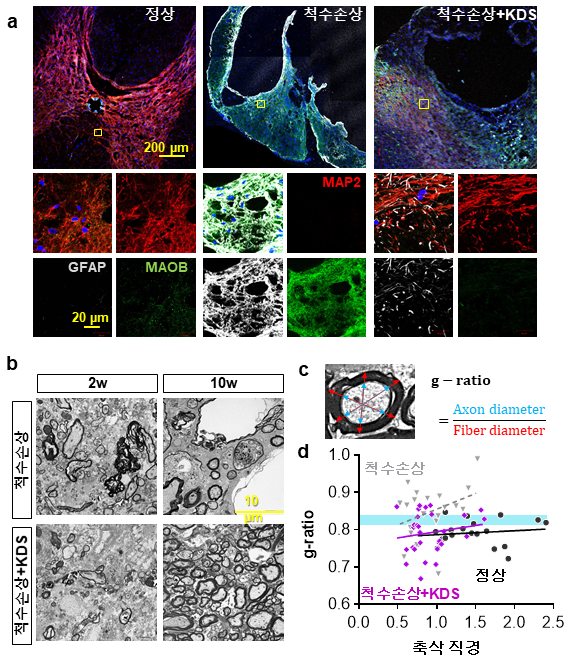
이에 착안해 연구진은 손상된 척수의 별세포를 분석해 가바가 신경세포 재생에 필요한 신경성장인자 ‘BDNF’와 그 수용체 ‘TrkB’ 발현을 억제한다는 것을 규명했다.
손상 후 회복에 필요한 신경 성장신호가 차단되면서 신경섬유의 재생과 기능 회복이 중단됐다. 이는 마오비에 의해 가바 생성경로가 척수손상의 회복 과정을 멈춰 세우는 제동장치로 작용하기 때문이다.
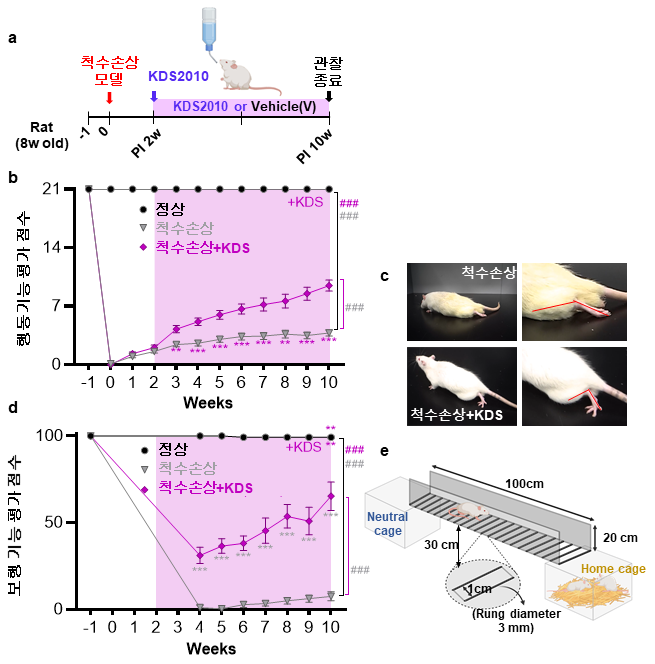
연구진은 이를 검증하기 위해 척수 별세포에서 마오비 발현을 억제하거나 활성화한 실험동물 모델을 이용, 척수손상 후 회복 과정을 비교했다.
분석결과 마오비 발현을 억제한 쥐는 손상된 신경섬유가 다시 자라나고, 뒷다리 운동 기능이 크게 회복됐다.
반면 마오비 발현이 증가한 쥐에서는 척수 단면적이 정상 대비 절반 가까이 줄어드는 심각한 손상이 나타났고, 운동기능도 거의 회복되지 않았다.
이는 마오비-가바 경로가 척수손상 회복을 막는 직접 원인임을 의미한다.
또 연구진은 마오비 억제제 ‘KDS2010’을 척수손상 동물에 투여해 효과를 확인했다.
약물을 투여한 쥐는 사다리 걷기 시험에서 뒷다리 미끄러짐이 줄어드는 등 보행 능력이 크게 개선됐고, 손상 부위에서 신경섬유가 새롭게 뻗어 나왔다.
척수단면 분석에서 손상으로 생긴 빈 공간이 줄고 수초화 된 신경섬유가 증가했다.
이는 영장류 모델에서도 손상조직 손실이 현저히 줄고 신경이 보존되는 효과가 확인됐다.
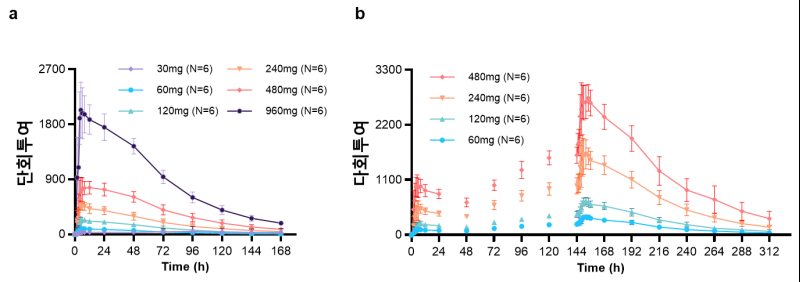
특히 건강한 성인을 대상으로 한 임상 1상 시험에서 약물의 우수한 안정성과 내약성을 검증, 실제 치료제로 발전 가능성을 높였다.
연구진은 KDS2010의 임상 2상 시험으로 실제 척수손상 환자의 치료 효과를 검증하고, 마오비-가바 경로가 다른 신경질환에 관여하는지 밝혀 적용 범위를 넓히고 보다 정밀한 치료 플랫폼으로 발전시킬 계획이다.
이 단장은 “이번 연구는 척수손상 후 신경 재생을 직접 억제하는 분자적 경로를 규명하고 이를 제어하는 전략으로 기존과 차별화된 근본적 치료 가능성을 제시한 것”이라며 “동물실험과 임상 1상까지 다층적 검증으로 신약 후보물질이 실제 치료로 이어질 수 있음을 뒷받침하는 중요한 근거를 확인했다”고 설명했다.
이어 "별세포의 병리적 반응을 정밀 제어하는 세포·유전자 치료 전략과의 병용 가능성도 탐색, 복합적 치료 플랫폼으로 발전시킬 계획"이라고 덧붙였다.
한편, 이번 연구는 한국연구재단 지원을 받아 서울대, KIST, 뉴로바이오젠 등 다기관 협력으로 수행됐고, 연구결과는 국제학술지 ‘신호전달 및 표적치료(Signal Transduction and Targeted Therapy, IF=52.7, 2024 JCR)’ 11일자에 게재됐다.




































