암세포의 약물 내성은 항암제가 치료 효과를 잃는 주원인이다. 약물 내성은 암세포의 대사가 변화하면서 생기는 것으로 알려졌다.
세포 대사는 감염병, 퇴행성질환 등 다양한 난치성 질환에서 중요한 역할을 한다.
이에 학계는 약물 내성 암세포의 대사를 민감 상태로 되돌리면 약물 효과가 돌아온다는 가설에 따라 다양한 생물학 정보를 활용해 내성 암세포에서 발현된 유전자나 단백질을 분석했다.
그러나 세포 대사는 수많은 유전자와 단백질들이 복잡하게 상호작용하는 시스템으로, 단순히 약물 내성 암세포에서 유의하게 발현된 유전자를 조절하는 것만으로는 약물 반응성을 높이기 위한 대사 상태변화를 유도하기 어렵다.
지금까지 관련 연구는 항암제 내성 암세포를 사멸할 수 있는 새로운 약물 표적 발굴에 집중했지만, 이는 오히려 더 강한 약물 내성을 유도할 수 있다.
항암제 내성 회복 방법 찾다
KAIST 생명화학공학과 김현욱·김유식 교수 연구팀이 내성 암세포를 다시 약물에 반응하게 만들 수 있는 핵심 유전자를 자동으로 예측하는 컴퓨터 기반 방법론을 개발했다.
이 기술은 다양한 암 치료는 물론 당뇨병 등 난치성 대사질환에도 활용될 수 있다.
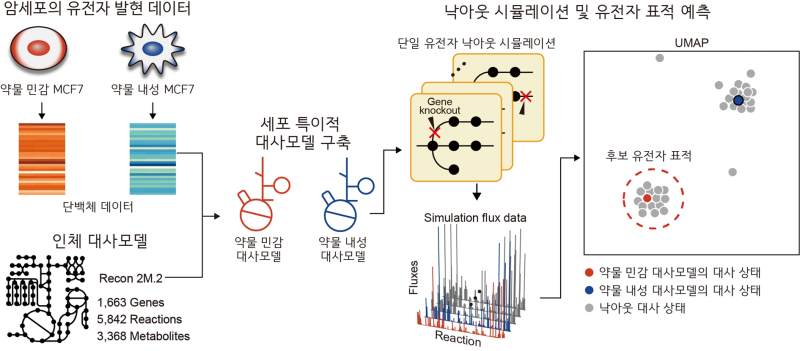
연구팀이 개발한 ‘대사모델 기반 항암제 내성 유방암의 민감화 유전자 표적 예측 방법론’은 인체 대사를 시뮬레이션할 수 있는 대사 네트워크 모델을 활용해 항암제에 내성을 가진 유방암 세포를 약물에 민감화하는 새로운 약물표적을 예측할 수 있다.
연구팀은 암세포의 대사 변형이 약물 내성 형성에 관여하는 주요 특징으로 주목, 항암제 내성 유방암 세포의 대사를 조절해 약물 반응성을 높일 유전자 표적을 예측하는 대사 네트워크 모델 기반 방법론을 구상했다.
이에 따라 독소루비신과 파클리탁셀에 각각 내성을 지닌 MCF7 유방암 세포주에서 얻은 단백체 데이터를 통합해 세포별 대사 네트워크 모델을 구축했다.
이어 모든 대사 유전자에 대해 유전자 낙아웃 시뮬레이션을 수행했다. 유전자 낙아웃 시뮬레이션은 특정 유전자를 가상으로 제거한 상태에서 생물학적 네트워크의 변화를 계산적으로 예측하는 방법이다.
시뮬레이션 결과 특정 유전자의 단백질을 억제하면 항암제에 잘 듣지 않던 내성 암세포가 다시 항암제에 반응하도록 만들 수 있음을 확인했다.
독소루비신 내성 세포에서는 GOT1 유전자를, 파클리탁셀 내성 세포에서는 GPI 유전자를 선별했고, 두 약물 공통으로 SLC1A5 유전자를 표적으로 선별했다.
선별된 유전자의 단백질에 대한 억제제를 투여한 결과 각 내성 암세포에서 항암제에 대한 민감성이 증가함을 확인했다.
아울러 같은 항암제에 내성을 갖는 다른 종류 유방암 세포에서도 같은 유전자를 억제했을 때 항암제에 다시 민감해지는 효과가 일관되게 나타남을 확인했다.
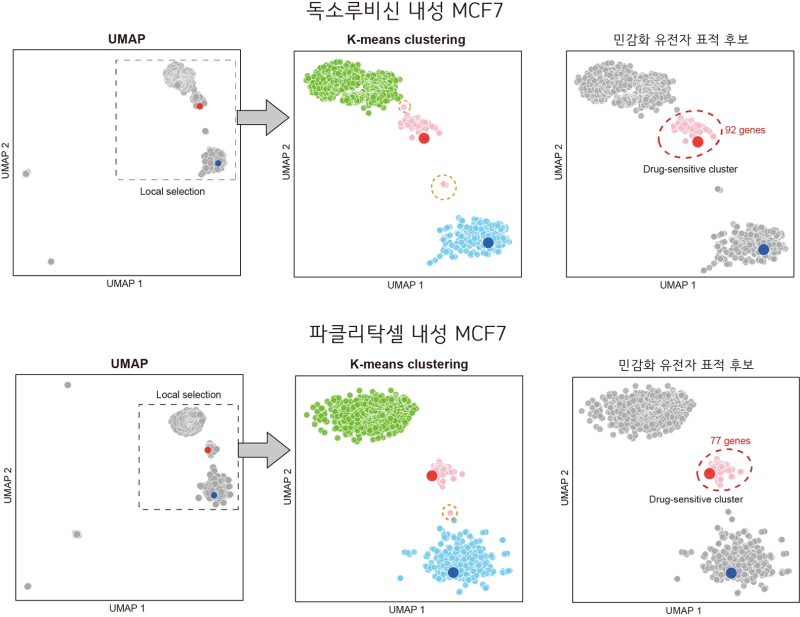
이는 기존 대규모 실험적 스크리닝 없이도 컴퓨터 기반 예측으로 핵심 대사 조절자를 발굴할 수 있음을 보여준다.
이번에 개발한 대사조절 스위치 예측기술은 약물 내성 유방암 치료를 넘어 치료제가 없는 다양한 대사질환에도 적용될 수 있는 기반기술이 될 것으로 기대된다.
김현욱 교수는 “이번 연구는 컴퓨터 시뮬레이션과 최소한의 실험데이터만으로 내성 암세포를 다시 약물에 반응하게 만들 수 있는 핵심 유전자를 정밀하게 예측한 것”이라며 “이 방법론은 다양한 암종과 대사관련 난치성질환의 새로운 치료표적 발굴에도 폭넓게 활용될 수 있을 것”이라고 설명했다.
한편, 이번 연구는 KAIST 생명화학공학과 임진아 박사과정생과 정해덕 박사과정생이 공동 제1저자로 참여했고, 연구결과는 지난달 25일 국제학술지인 ‘미국국립과학원회보(PNAS)’ 온라인에 게재됐다.
(논문명 : Genome-scale knockout simulation and clustering analysis of drug-resistant breast cancer cells reveal drug sensitization targets ※DOI: https://doi.org/10.1073/pnas.2425384122)