세계 암 사망률 1위인 폐선암(LUAD)은 진단 시점에서 이미 암이 진행된 상태가 많아 치료가 어렵다.
기존 표적치료제나 면역항암제는 정상세포까지 공격해 치료내성과 낮은 약물전달효율 문제와 더불어 탈모, 구토, 면역력 저하 등 부작용도 크다.
특히 기존 항체치료제로 사용되는 일반 항체는 크고 조직침투력이 낮으면서도 생산비용은 높아 이를 극볼할 수 있는 나노바디가 차세대 항체 치료제로 주목받고 있다.
나노바디(Nanobody)는 낙타과 동물의 혈액 속에 존재하는 중쇄 항체의 항원 결합부위를 유전공학적으로 분리 제작한 차세대 항체 치료 플랫폼이다.
폐암 표적치료 나노바디 기술
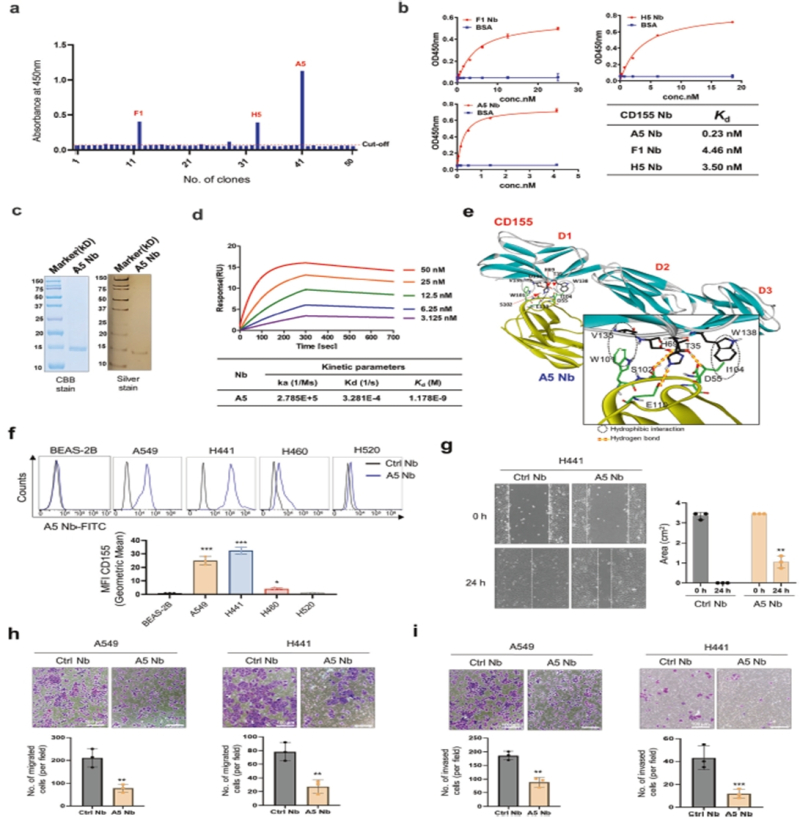
한국생명공학연구원(원장 권석윤, 이하 생명연) 바이오나노연구센터 정주연 박사팀이 폐암세포만 정확히 인식해 공격할 수 있는 ‘A5 나노바디' 기술을 개발, 암 치료의 새가능성을 제시했다.
이번 성과는 기존 항암제의 부작용을 줄이면서 암세포 사멸효과는 극대화한 혁신기술로, 폐선암에 효과적인 치료법을 제시할 것으로 기대된다.
연구팀은 폐선암 세포에서 많이 발견되는 단백질인 CD155에 특이적으로 결합하는 초소형 항체 A5 나노바디를 개발했다.
CD155는 면역세포와 암세포 사이에서 면역반응을 조절하는 역할을 하며, 암세포에서 발현이 높아 암 연구에 중요한 단백질로 주목받고 있다.
A5 나노바디는 크기가 일반 항체보다 1/10 수준으로 작아 몸속 깊은 곳까지 잘 침투하고, 암세포 표면에만 달라붙는 정밀함도 뛰어나 정상세포에 영향을 거의 주지 않고 CD155가 많은 폐선암 세포에 선택적으로 붙어 이동과 침투를 50% 이상 억제했다.
특히 세포 부착 신호 단백질인 팍실린(PXN) 발현을 낮추고, 팍실린이 세포막 부착 부위에 모이는 것을 차단해 세포가 확산되지 못하도록 했다.
또 연구팀은 항암제 독소루비신(DOX)을 담은 지방 성분의 약물캡슐 리포좀에 A5 나노바디를 결합한 ‘A5-LNP-DOX’를 개발했다.
이는 드론이 암세포를 정말 겨냥해 약물을 전달하듯 암세포 표면에 존재하는 CD155 표적에 항암제를 정확하게 도달시키는 방식이다.
실제 A5-LNP-DOX는 기존 방식보다 암세포 내부로 전달되는 약물의 양이 3배 이상 증가했고, 정상 세포에는 거의 영향을 주지 않으면서 암세포 사멸 효과는 크게 향상됐다.
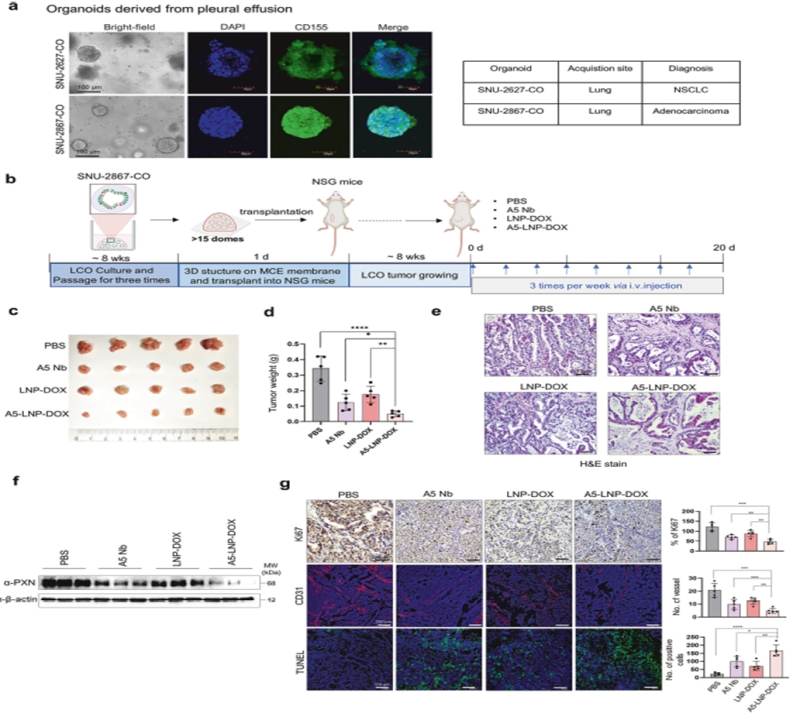
아울러 동물실험과 환자 유래 오가노이드 모델을 활용한 실험에서도 종양 크기가 최대 90% 감소했고, 세포사멸 지표도 크게 증가했다.
이와 함께 간, 심장, 신장 등 주요 장기에 손상이 나타나지 않아 부작용 우려도 거의 없는 안전한 치료법으로 확인됐다.
정 박사는 "이번 연구성과는 기존 화학 항암제의 문제였던 비특이적 전달로 인한 독성, 저조한 침투력, 약물 저항성을 극복하고 종양 선택성과 생체 안전성을 동시에 높일수 있는 차세대 정밀 치료제 플랫폼을 제시한 것"이라며 "향후 다양한 암종 및 질환으로 플랫폼을 확장, 범용성 높은 바이오 신약 기술로 발전할 것으로 기대된다"고 설명했다.
한편, 이번 연구결과는 지난달 10일 국제학술지 ‘Signal Transduct Target Therap(IF 52.7)’에 게재됐다.
(논문명 : Targeting CD155 in lung adenocarcinoma: A5 nanobodybased therapeutics for precision treatment and enhanced drug delivery / 교신저자 : 정주연 박사 / 제1저자 : 노경희·이소연 박사)
































